Autor : Aleksandra Kurowska
2023-05-17 15:06
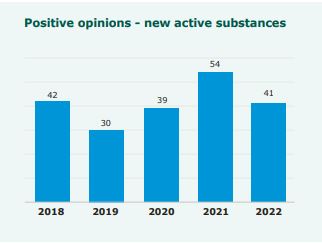
Dopuszczenie do obrotu 89 leków stosowanych u ludzi, w tym 41 z nową substancją czynną zarekomendowała w zeszłym roku EMA, czyli Europejska Agencja Leków. Nowych substancji było mniej niż rok wcześniej, ale i tak wskazano, że część z nich daje znaczący postęp w leczeniu. Leki z jakich obszarów oceniano?
Roczne sprawozdania zawierają przegląd prac EMA wraz z europejską siecią regulacyjną ds. leków. Zawierają:
kluczowe osiągnięcia w zakresie ochrony i promowania zdrowia publicznego i zdrowia zwierząt w UE;
przemyślenia pracowników EMA oraz jej partnerów i interesariuszy na tematy o największym znaczeniu dla medycyny i zdrowia;
podstawowe statystyki, które przedstawiają główne wyniki działań Agencji oraz interesujące trendy i zmiany zaobserwowane w ostatnich latach.
Raport zawiera przegląd zaleceń EMA dotyczących leczenia COVID-19 i małpiej ospy. Ponadto zwraca uwagę na działania Agencji prowadzone w celu wdrożenia rozporządzenia UE wzmacniającego rolę EMA w zakresie zarządzania kryzysowego produktami leczniczymi i wyrobami medycznymi.
Raport pokazuje również, w jaki sposób EMA zaspokajała potrzeby wykraczające poza stany zagrożenia zdrowia publicznego. W 2022 r. Agencja zarekomendowała dopuszczenie do obrotu 89 leków stosowanych u ludzi, w tym 41 z nową substancją czynną. Wiele z nich było ogromnym postępem w konkretnych obszarach terapeutycznych.
 Reforma unijnego prawa farmaceutycznego: zestawienie propozycji
Reforma unijnego prawa farmaceutycznego: zestawienie propozycji
Raport roczny EMA zwraca również uwagę na inne ważne osiągnięcia Agencji, działania o dużym wpływie i wyzwania w 2022 r. Należą do nich: wdrożenie rozporządzenia w sprawie badań klinicznych, które weszło w życie w styczniu 2022 r. oraz udane uruchomienie Trials Information System (CTIS) i inicjatywa Accelerating Clinical Trials in the EU (ACT EU), które zmieniają sposób inicjowania, projektowania i prowadzenia badań klinicznych w Europie.
EMA wskazała też leki, które reprezentują znaczący postęp w swoich obszarach terapeutycznych:
Beyfortus - pierwszy lek do zapobiegania chorobom dolnych dróg oddechowych wywołanym wirusem syncytialnym układu oddechowego (RSV) u noworodków i niemowląt w pierwszym sezonie zakażenia wirusem RSV (kiedy istnieje ryzyko zakażenia RSV w środowisku).
Breyanzi - terapia genowa stosowana w leczeniu dorosłych pacjentów z trzema podtypami chłoniaka nieziarniczego (rozlany chłoniak z dużych komórek B (DLBCL), pierwotny chłoniak z dużych komórek śródpiersia (PMBCL) i chłoniak grudkowy stopnia 3B (FL3B)), u których doszło do nawrotu choroby nowotworowej lub u których nie wystąpiła odpowiedź na leczenie po dwóch lub więcej liniach leczenia systemowego.
Carvykti - w leczeniu osób dorosłych z nawracającym i opornym na leczenie szpiczakiem mnogim, u których zastosowano co najmniej trzy wcześniejsze terapie i u których stan nowotworu uległ pogorszeniu od czasu ostatniego leczenia.
Ebvallo - do leczenia choroby limfoproliferacyjnej po przeszczepie z obecnością wirusa Epsteina-Barra. Ta somatyczna terapia komórkowa jest przeznaczona dla pacjentów dorosłych i dzieci, u których ten nowotwór rozwija się po przeszczepie w wyniku immunosupresji spowodowanej lekami wymaganymi do zmniejszenia możliwości odrzucenia przeszczepionego narządu lub szpiku kostnego.
Hemgenix - pierwsza terapia genowa do leczenia ciężkiej i średnio ciężkiej postaci hemofilii B u dorosłych, dziedzicznej choroby charakteryzującej się zwiększoną skłonnością do krwawień z powodu częściowego lub całkowitego niedoboru aktywności czynnika IX.
Kimmtrak - monoterapia stosowana w leczeniu dorosłych pacjentów z postacią raka oka zwaną czerniakiem błony naczyniowej oka.
Mounjaro - pierwszy w swojej klasie lek, który aktywuje zarówno receptory GLP-1, jak i GIP, co prowadzi do poprawy kontroli poziomu cukru we krwi u osób dorosłych z cukrzycą typu 2.
Roctavian - do leczenia ciężkiej hemofilii A u dorosłych, którzy nie mają inhibitorów czynnika VIII (autoprzeciwciał wytwarzanych przez układ odpornościowy, które zmniejszają skuteczność leków zawierających czynnik VIII) ani przeciwciał przeciwko serotypowi 5 wirusa związanego z adenowirusami (AAV5).
Upstaza - pierwszy lek dla pacjentów dorosłych i dzieci z niedoborem dekarboksylazy aromatycznych L-aminokwasów (AADC), niezwykle rzadką chorobą genetyczną wpływającą na układ nerwowy.
Xenpozyme - pierwsza terapia do leczenia pacjentów dorosłych i dzieci z niedoborem kwaśnej sfingomielinazy (ASMD), rzadką chorobą genetyczną, historycznie znaną jako choroba Niemanna-Picka typu A, A/B i B.
Zokinvy - pierwszy lek dla dzieci z zespołami progeroidów, niezwykle rzadką chorobą genetyczną, która powoduje przedwczesne starzenie się i śmierć.
COVID-19 Vaccine Valneva i VidPrevtyn Beta, dwie szczepionki zapobiegające COVID-19 u dorosłych.
Paxlovid (dla dorosłych) i Evusheld (dla dorosłych i młodzieży w wieku 12 lat i starszych), dwie metody leczenia COVID-19.
W 2022 r. pięć leków otrzymało rekomendację dopuszczenia do obrotu w wyniku przyspieszonej oceny: Beyfortus, Kimmtrak, Lunsumio, Tecvayli i Xenpozyme. Mechanizm ten jest zarezerwowany dla leków, które są w stanie zaspokoić niezaspokojone potrzeby medyczne. Pozwala na szybszą ocenę kwalifikujących się leków przez komitety naukowe EMA (maksymalnie w ciągu 150 dni zamiast 210).
Dwie szczepionki i dwa sposoby leczenia COVID-19 zalecane do zatwierdzenia przez EMA w 2022 r. zostały ocenione w ramach przeglądu kroczącego. EMA może wykorzystać tę ścieżkę regulacyjną podczas pandemii, aby przyspieszyć ocenę leków, oceniając dane, które staną się dostępne z trwających badań.
Dziewięć leków otrzymało zalecenie warunkowego pozwolenia na dopuszczenie do obrotu, co jest jedną z możliwości zapewnienia pacjentom wczesnego dostępu do nowych leków w UE: Carvykti, Hemgenix, Kinpeygo, Lunsumio, Paxlovid, Roctavian, Spevigo, Tecvayli i Zynlonta.
Pozwolenie warunkowe umożliwia wcześniejsze zatwierdzenie na podstawie mniej kompletnych danych klinicznych, niż jest to zwykle wymagane (produkty do stosowania w sytuacjach nagłych mogą mieć mniej kompletne dane farmaceutyczne lub niekliniczne), ponieważ korzyści z wcześniejszego dostępu dla pacjentów przewyższają potencjalne ryzyko związane z ograniczonym dane. Pozwolenia te podlegają szczególnym obowiązkom po wydaniu pozwolenia, polegającym na wygenerowaniu pełnych danych o lekach.
Pięć leków ( Ebvallo, Livmarli, Nulibry, Upstaza i Zokinvy) zostało dopuszczonych do obrotu w wyjątkowych okolicznościach. To droga umożliwiająca pacjentom dostęp do leków, które nie mogą zostać dopuszczone w ramach standardowego pozwolenia, ponieważ nie można uzyskać wyczerpujących danych ze względu na to, że jest bardzo niewielu pacjentów z chorobą lub zebranie pełnych informacji o skuteczności i bezpieczeństwie leku byłoby nieetyczne; nie można uzyskać kompleksowych danych nawet po dopuszczeniu do obrotu. Leki te podlegają szczególnym obowiązkom po wydaniu pozwolenia i monitorowaniu.
Raport roczny EMA 2022 jest dostępny w dwóch formatach:
Wersja cyfrowa: zobacz online interaktywną oś czasu głównych działań EMA w 2022 r. oraz materiały wizualne i audiowizualne dogłębnie omawiające tematy
Wersja PDF: do pobrania i wydrukowania, zawierająca dalsze dane liczbowe i statystyki dotyczące procedur i działań regulacyjnych EMA.
Sprawozdanie roczne Europejskiej Agencji Leków za 2022 r. (PDF/9,48 MB) (nowe)
Załączniki - Sprawozdanie roczne Europejskiej Agencji Leków za 2022 r. (PDF/1,44 MB) (nowe)
Załącznik 10 – Sprawozdanie roczne Europejskiej Agencji Leków za 2022 r. – opinie CHMP dotyczące wstępnych ocen i rozszerzeń wskazań terapeutycznych (XLSX/145.05 KB)
Polecamy także:
 Leki: które są nieodpowiednie dla seniorów? Nowe Kryteria Beers'a
Leki: które są nieodpowiednie dla seniorów? Nowe Kryteria Beers'a
Redaktor naczelna, od ponad 20 lat pracuje w mediach. Była redaktor naczelna Polityki Zdrowotnej, redaktor m.in. w Rzeczpospolitej, Dzienniku Gazecie Prawnej. Laureatka branżowych nagród dla dziennikarzy i mediów medycznych oraz Polskiej Izby Ubezpieczeń. Kontakt: aleksandra.kurowska@cowzdrowiu.pl