Autor : Aleksandra Kurowska
2023-01-11 13:15
Ile technologii sfinansowano z Funduszu Medycznego? Jakie były na nie wydatki? W ilu przypadkach i których leków producenci w ogóle nie złożyli wniosku o refundację leków wpisanych na listy terapii o o wysokim poziomie innowacyjności lub wartości klinicznej? Które leki rzeczywiście sfinansowano z Funduszu, a które - mimo, że były na listach TLI I TLK poszły tradycyjną ścieżką finansowania? Na pytania naszej redakcji odpowiedziało Ministerstwo Zdrowia i jest to naszym zdaniem kompleksowe opracowanie, porządkujące wiedzę na ten temat.
Dla przypomnienia, Fundusz Medyczny to mechanizm finansowania niektórych zadań zdrowotnych (np. nowoczesnych terapii czy inwestycji w szpitalny sprzęt) osobną ścieżką i przynajmniej teoretycznie z osobnych, dodatkowych pieniędzy.
Projekt ustawy o Funduszu Medycznym formalnie został przygotowany przez Kancelarię Prezydenta.
Celem Funduszu jest zapewnienie dodatkowych źródeł finansowania na obszary, gdzie stwierdzono deficyty, a np. jak w lekach, niektórym terapiom ze względu choćby na wysoką cenę lub inne względy, ciężko byłoby uzyskać szybką refundację tradycyjną ścieżką, w oparciu o przepisy ustawy refundacyjnej.
Z Funduszu mogą być finansowane:
profilaktyka, wczesne wykrywanie, diagnostyka i leczenia chorób cywilizacyjnych, w tym chorób nowotworowych i chorób rzadkich;
rozwój infrastruktury ochrony zdrowia wpływającej na jakość i dostępność oraz bezpieczeństwo udzielanych świadczeń opieki zdrowotnej (np. szpitalne łóżka);
dostęp do wysokiej jakości świadczeń opieki zdrowotnej;
rozwój systemu opieki zdrowotnej przez m.in. poprawę jakości życia pacjentów i ich rodzin;
świadczenia opieki zdrowotnej udzielane osobom do ukończenia 18 roku życia - pisaliśmy o tym. m.in. tutaj: Fundusz Medyczny: ponad 2 mln dzieci skorzystało w 2022 r.
świadczenia udzielane pacjentom poza granicami kraju - chodzi np. o operacje, które wykonuje się rzadko i zagraniczne ośrodki mają w nich doświadczenie (np. niektóre operacje serca u dzieci). Chodzi o to, by rodzice nie musieli organizować na nie zbiórek.
Trwa przygotowanie do podpisania umowy na 2023 r., która dotyczy finansowania ze środków Funduszu Medycznego terapii "udostępnianych" przez NFZ. Środki przewidziane na dostęp do leków o wysokim poziomie innowacyjności lub wartości klinicznej w ramach Funduszu Medycznego będą wspólnymi środkami ze środkami na całkowity budżet na refundację z Narodowego Funduszu Zdrowia. O jakie kwoty chodzi? Zgodnie z zawartą umową na 2022 r. na finansowanie technologii wyasygnowano kwotę 770,94 mln zł.
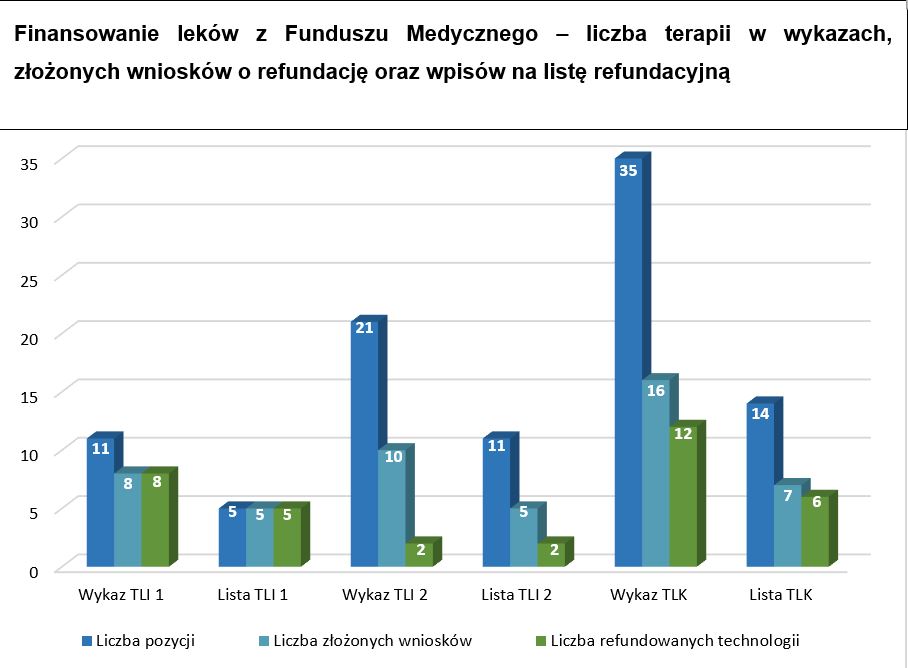
| Liczba pozycji | Liczba złożonych wniosków | Procent złożonych wniosków | Liczba refundowanych technologii | Procent refundowanych technologii ze złożonych wniosków | Zgodność ze ścieżką procedowania TLI/TLK | Procent zgodności ze ścieżką procedowania TLI/TLK |
Wykaz TLI 1 | 11 | 8 | 73% | 8 | 100% | 5 | 63% |
Lista TLI 1 | 5 | 5 | 100% | 5 | 100% | 5 | 100% |
Wykaz TLI 2 | 21 | 10 | 48% | 2 | 20% | 2 | 20% |
Lista TLI 2 | 11 | 5 | 45% | 2 | 40% | 2 | 40% |
Wykaz TLK | 35 | 16 | 46% | 12 | 75% | 6 | 38% |
Lista TLK | 14 | 7 | 50% | 6 | 86% | 6 | 86% |
Zgodnie z art. 33 ust. 1 ustawy o Funduszu Medycznym[1], w danym roku kalendarzowym środki Funduszu (z części dotyczącej subfunduszu terapeutyczno-innowacyjnego) w wysokości nie większej niż 10% wartości całkowitego budżetu na refundację, przeznacza się na finansowanie technologii lekowej o wysokiej wartości klinicznej lub technologii lekowej o wysokim poziomie innowacyjności.
Środki przewidziane na dostęp do leków o wysokim poziomie innowacyjności lub wartości klinicznej w ramach Funduszu Medycznego będą wspólnymi środkami ze środkami na całkowity budżet na refundację z Narodowego Funduszu Zdrowia. Zgodnie z zawartą umową na 2022 r. na finansowanie technologii wyasygnowano kwotę 770,94 mln zł. Obecnie twa przygotowanie do podpisania umowy na 2023 rok.
Pierwszy wykaz TLI Agencja Oceny Technologii Medycznych i Taryfikacji przekazała Ministrowi Zdrowia 26 lutego 2021 r. A pierwszą listę TLI Minister Zdrowia publikował 19 maja 2021 r.
Objęcie refundacją technologii z pierwszej listy TLI
Dla wszystkich 5 technologii lekowych o wysokim poziomie innowacyjności z pierwszej listy Ministra Zdrowia[2], podmioty odpowiedzialne złożyły wnioski o objęcie refundacją i ustalenie urzędowej ceny zbytu leku.
Aktualnie 5 technologii zostało objętych refundacją, tj.:
- Givlaari (givosiranum) – objęty refundacją od 1 stycznia 2022 r., w ramach programu lekowego „B.128.FM. - Leczenie chorych na ostrą porfirię wątrobową (ahp) u dorosłych i młodzieży w wieku od 12 lat (icd-10: e80.2)”. Do programu lekowego kwalifikowani są pacjenci z udokumentowaną diagnozą ostrej porfirii wątrobowej (AIP – ostra porfiria przerywana, HCP – dziedziczna koproporfiria, VP – porfiria mieszana, ADP – porfiria z niedoborem dehydratazy kwasu aminolewulinowego).
- Oxlumo (lumasiranu) – objęty refundacją od 1 marca 2022 r., w ramach programu lekowego „B.129.FM - Leczenie chorych na pierwotną hiperoksalurię typu 1 (icd-10: e74.8)”. Do programu lekowego kwalifikowani są pacjenci z przewlekłą chorobą nerek w stadium I-III.
- Dovprela (pretomanid) – objęty refundacją od 1 września 2022 r., w ramach programu lekowego „B.136.FM - Leczenie chorych na gruźlicę lekooporną (MDR/XDR) (ICD-10: A15)”. Leczenie wielolekoopornej gruźlicy płuc (MDR-TB) lub gruźlicy płuc o rozszerzonej oporności (XDR-TB) pretomanidem w skojarzeniu z linezolidem i bedakiliną u pacjentów, u których wystąpił udokumentowany brak odpowiedzi na leczenie najlepszymi dostępnymi schematami.
- Idefirix (Imlifidasum) – objęty refundacją od 1 września 2022 r., w ramach programu lekowego „B.137.FM - Odczulanie wysoko immunizowanych dorosłych potencjalnych biorców przeszczepu nerki (ICD-10: N18)”. Terapia udostępniona pacjentom, u których występuje małe prawdopodobieństwo przeszczepienia w ramach dostępnych systemów alokacji nerek, w tym programów priorytetyzacji dla wysoko immunizowanych pacjentów, jak również pacjentom, którzy są ponad rok na Krajowej Liście Oczekujących na Przeszczepienie.
- Zolgensma[3] (onasemnogenum abeparvovecum) – objęty refundacją od 1 września 2022 r., w ramach programu lekowego „B.102.FM. - Leczenie chorych na rdzeniowy zanik mięśni (icd-10: g12.0, g12.1)”. Terapia dostępna wyłącznie dla dzieci bez jakiegokolwiek wcześniejszego leczenia z powodu SMA w wieku do 6 miesiąca życia (<180 dni). Do terapii kwalifikowani zostaną pacjenci przedobjawowi i objawowi z rozpoznaniem rdzeniowego zaniku mięśni (SMA) 5q z bialleliczną mutacją genu SMN1 i z nie więcej niż 3 kopiami genu SMN2 badani w ramach Rządowego Programu Badań Przesiewowych Noworodków w Polsce lub prenatalnie w Polsce[4].
W ramach programu lekowego B.102.FM od 1 września 2022 r. objęto refundacją również lek Evrysdi (risdiplam) w standardowej ścieżce refundacyjnej. Produkt leczniczy w postaci proszku do sporządzania roztworu doustnego, przyjmowany doustnie w wygodnej postać farmaceutycznej. Do leczenia kwalifikowani są pacjenci w wieku 2 miesięcy i starsi z klinicznym rozpoznaniem SMA typu 1, typu 2 lub typu 3 lub posiadający od jednej do czterech kopii genu SMN2. Grupą docelową są pacjenci mający przeciwwskazania do leczenia dotychczas jedyną, refundowaną terapią w leczeniu dzieci chorych na SMA – Spinraza (nusinersen).
Objęcie refundacją dwóch kolejnych terapii na rdzeniowym zanikiem mięśni (SMA), tj. Zolgensma w ramach Funduszu Medycznego oraz leku Evrysdi w ramach standardowej ścieżki refundacyjnej, zapewniło pełny i równy dostęp do leczenia wszystkim chorym na SMA w Polsce.
W przypadku dostępności nowych, innowacyjnych leków w ramach programu lekowego NFZ musi rozpocząć proces kontraktowania (wraz z uzgadnianiem warunków SMPT – elektronicznego Systemu Monitorowania Programów lekowych) świadczenia na podstawie zarządzenia prezesa NFZ. Po niezbędnych konsultacjach odbywa się konkurs ofert na realizację danego programu. Następnie świadczeniodawca wybiera oferty i przystępuje do realizacji umowy. Minimalny czas niezbędny na zawarcie takiej umowy wynosi co najmniej 2 miesiące.
Wobec danych (sprawozdanie NFZ, stan na 30 listopada 2022 r.), na finansowanie leków w ramach technologii lekowej o wysokim poziomie innowacyjności (TLI), o której mowa w art. 2 pkt 24b ustawy o refundacji leków, wydatkowano 37,343 mln zł (łącznie do końca listopada 2022 r.). Leczenie rozpoczęło 18 pacjentów, w tym 12 pacjentów lekiem Givlaari[5] (givosiranum) w ramach programu lekowego „B.128.FM - Leczenie chorych na ostrą porfirię wątrobową (ahp) u dorosłych i młodzieży w wieku od 12 lat”, 2 pacjentów lekiem Oxlumo (lumasiranu) w ramach programu lekowego „B.129.FM - Leczenie chorych na pierwotną hiperoksalurię typu 1 (icd-10: e74.8), 4 pacjentów lekiem Zolgensma (onasemnogenum abeparvovecum) w ramach programu lekowego „B.102.FM. - Leczenie chorych na rdzeniowy zanik mięśni (icd-10: g12.0, g12.1)”.
Objęcie refundacją technologii z drugiej listy TLI
• Drugi wykaz TLI[6] Agencja Oceny Technologii Medycznych i Taryfikacji przekazała Ministrowi Zdrowia 25 lutego 2022 r. Drugą listę TLI[7] Minister Zdrowia opublikował 31 maja 2022 r.
AOTMiT ustala poziom innowacyjności technologii lekowych stosowanych w onkologii lub chorobach rzadkich oraz ustala dane gromadzone w rejestrze medycznym, w tym między innymi wskaźniki oceny efektywności terapii i oczekiwanych korzyści zdrowotnych w formie wykazu nie rzadziej niż raz do roku. AOTMiT opracowała i opublikowała drugi wykaz TLI 25 lutego 2022 roku. Minister Zdrowia po zasięgnięciu opinii Rady Przejrzystości, Konsultantów Krajowych z danej dziedziny medycyny oraz Rzecznika Praw Pacjenta, opublikował listę TLI 31 maja 2022 r. na stronie internetowej oraz w Biuletynie Informacji Publicznej, informując tym samym podmioty odpowiedzialne, których technologie lekowe znalazły się na tej liście, o możliwości złożenia wniosku o refundację i ustalenie urzędowej ceny zbytu.
Lp. | Nazwa leku | Substancja czynna | Wskazanie | ONKO/NIEONKO | Choroba rzadka |
1. | Bylvay | odewiksybat | postępująca rodzinna cholestaza wewnątrzwątrobowa (ang. progressive familial intrahepatic cholestasis, PFIC) u pacjentów w wieku od 6 miesięcy | NIEONKO | TAK |
2. | Enspryng | satralizumab | choroby ze spektrum zapalenia nerwów wzrokowych oraz rdzenia kręgowego (zespół Devic'a), monoterapia lub w skojarzenie z terapią immunosupresyjną u pacjentów dorosłych i młodzieży w wieku powyżej 12 lat, u których występują przeciwciała IgG przeciwko akwaporynie-4 (AQP4-IgG) | NIEONKO | TAK |
3. | Fintepla | fenfluramina | napady padaczkowe związane z zespołem Dravet, jako dodatek do leczenia innymi lekami przeciwpadaczkowymi u pacjentów w wieku od 2 lat | NIEONKO | TAK |
4. | Imcivree | setmelanotyd | otyłość i kontrola uczucia głodu towarzyszącego potwierdzonemu w badaniach genetycznych związanemu z bialleliczną utratą funkcji niedoborowi roopiomelanokortyny (POMC), w tym PCSK1, lub receptora leptyny (LEPR) u osób dorosłych i dzieci w wieku od 6 lat | NIEONKO | NIE |
5. | Koselugo | selumetynib | leczenie objawowych, nieoperacyjnych nerwiakowłókniaków splotowatych (ang. plexiform neurofibromas, PN) u dzieci i młodzieży w wieku 3 lat i starszych z neurofibromatozą typu 1 (NF1) | ONKO | TAK |
6. | Libmeldy | atidarsagen autotemcel | leukodystrofia metachromatyczna (ang. metachromatic leukodystrophy, MLD) odznaczająca się dwuallelowymi mutacjami genu arylosulfatazy A prowadzącymi do zmniejszenia aktywności enzymatycznej ARSA, w przypadku: - dzieci z późnymi niemowlęcymi albo wczesnymi młodzieńczymi postaciami choroby, bez objawów klinicznych choroby; - dzieci z wczesną młodzieńczą postacią choroby, z wczesnymi objawami klinicznymi choroby, mogące nadal poruszać się samodzielnie, przed pojawieniem się zaburzenia funkcji poznawczych | NIEONKO | TAK |
7. | Minjuvi | tafasytamab | nawrotowa albo oporna na leczenie postać chłoniaka nieziarniczego rozlanego | ONKO | TAK |
8. | Retsevmo | selperkatynib | zaawansowany rak rdzeniasty tarczycy (RRT) z mutacją w genie RET, | ONKO | NIE |
9. | Tecartus | autologiczne transdukowane anty-CD19 komórki CD3-dodatnie | nawrotowy lub oporny na leczenie chłoniak z komórek płaszcza (ang. mantle cell lymphoma, MCL) u dorosłych pacjentów, którzy uprzednio otrzymali co najmniej dwie linie leczenia systemowego, w tym inhibitor kinazy tyrozynowej Brutona(ang. Bruton’s tyrosine kinase, BTK) | ONKO | TAK |
10. | Trodelvy | sacytuzumab gowitekan | nieresekcyjny lub przerzutowy potrójnie ujemny rak piersi (ang. metastatic triplenegative breast cancer, mTNBC), w monoterapii, u dorosłych pacjentów, którzy wcześniej otrzymali co najmniej dwie linie leczenia systemowego, w tym co najmniej jedną w zaawansowanej chorobie | ONKO | NIE |
11. | Voxzogo | wosorytyd | achondroplazja u pacjentów w wieku co najmniej 2 lat, których nasady kości długiej nie są zamknięte | NIEONKO | TAK |
Wpłynęło 5 wniosków o objęcie refundacją technologii lekowych o wysokiej poziomie innowacyjności z drugiej listy TLI ( zgodnie z art. 24 ust.1 pkt. 1b ustawy o refundacji), tj.:
- Enspryng (satralizumab), we wskazaniu „Leczenie pacjentów ze spektrum zapalenia nerwów wzrokowych i rdzenia kręgowego (NMOSD) (ICD-10: G36.0)”, wniosek złożony 11 lipca 2022 r., decyzja refundacyjna wydana 19 października 2022 r. – objęty refundacją od 1 listopada 2022 r.,
- Trodelvy (sacituzumab govitecan), we wskazaniu „leczenie dorosłych pacjentów z nieresekcyjnym lub przerzutowym potrójnie ujemnym rakiem piersi (icd-10: c50)”, wniosek złożony 5 sierpnia 2022 r., prawidłowe uzupełnienie i złożenie wniosku nastąpiło 11 sierpnia 2022 r., decyzja refundacyjna wydana 18 października 2022 r. – objęty refundacją od 1 listopada 2022 r.,
- Minjuvi (tafasytamab) we wskazaniu „leczenie pacjentów dorosłych z nawrotową albo oporną na leczenie postacią chłoniaka nieziarniczego rozlanego z dużych komórek B (diffuse large B-cell lymphoma, DLBCL), którzy nie kwalifikują się do autologicznego przeszczepu komórek macierzystych (autologous stem cell transplant, ASCT)” – wniosek złożony 3 października 2022 r. – oczekuje na przygotowanie decyzji,
- Bylvay (odevixibat) we wskazaniu „LECZENIE ODEWIKSYBATEM W POSTĘPUJĄCEJ RODZINNEJ CHOLESTAZIE WEWNĄTRZWĄTROBOWEJ (PFIC) TYPU 1 I 2 U PACJENTÓW W WIEKU OD 6 MIESIĘCY (ICD-10: K76.8)” – wniosek złożony 8 października 2022 r. – oczekuje na przygotowanie decyzji,
- Libmeldy (atidarsagene autotemcel) we wskazaniu „LECZENIE DZIECI Z LEUKODYSTROFIĄ METACHROMATYCZNĄ” – wniosek złożony 30 grudnia 2022 r. – w trakcie oceny formalno-prawnej.
Dla kolejnej technologii z drugiej listy TLI, tj. Koselugo (wosorytyd) w ramach programu lekowego „LECZENIE OBJAWOWYCH, NIEOPERACYJNYCH NERWIAKOWŁÓKNIAKÓW SPLOTOWYCH U CHORYCH Z NEUROFIBROMATOZĄ TYPU 1 (NF1) (ICD-10: Q85.0)”, podmiot odpowiedzialny 23 listopada 2022 r. złożył wniosek o refundację i ustalenie urzędowej ceny zbytu leku na podstawie art. 24 ust. 1 pkt 1 ustawy o refundacji (w ramach standardowej ścieżki refundacyjnej), a nie w ramach technologii finansowanej z Funduszu Medycznego z art. 24 ust. 1b ustawy o refundacji.
Objęcie refundacją technologii z listy TLK
Lp. | Nazwa leku | Substancja czynna | Oceniane wskazanie | ONKO/ NIEONKO | Choroba rzadka | Status refundacyjny wg stanu na 4.01.2022 |
1 | Zinplava | bezlotoksumab | Zapobieganie nawrotom zakażenia wywoływanego przez Clostridium difficile u osób dorosłych z wysokim ryzykiem nawrotu zakażenia Clostridium difficile | NIEONKO | NIE | Brak wniosku |
2 | Jorveza | budezonid | Eozynofilowe zapalenie przełyku u osób dorosłych (w wieku powyżej 18 lat) | NIEONKO | TAK | Oczekuje na przygotowanie |
3 | Epidyolex | kannabidiol | Napady padaczkowe związane z zespołem Lennoxa-Gastauta u osób w wieku 2 lat lub starszych w skojarzeniu z klobazamem | NIEONKO | TAK | Brak wniosku |
4 | Epidyolex | kannabidiol | Napady padaczkowe związane z zespołem Dravet u osób w wieku 2 lat lub starszych w skojarzeniu z klobazamem | NIEONKO | TAK | Brak wniosku |
5 | Tecartus | autologiczne transdukowane anty-CD19 komórki CD3-dodatnie | Nawrotowy lub oporny na leczenie chłoniak z komórek płaszcza u osób dorosłych, które uprzednio otrzymali co najmniej dwie linie leczenia systemowego, w tym inhibitor kinazy tyrozynowej Bruton | ONKO | TAK | Brak wniosku |
6 | Kymriah | tisagenlecleucel | Nawrotowy lub oporny na leczenie chłoniak rozlany z dużych komórek B, po dwóch lub większej liczbie linii leczenia systemowego u osób dorosłych | ONKO | TAK | Decyzja wydana |
7 | Yescarta | aksykabtagen cyloleucel | Nawrotowy lub oporny na leczenie chłoniak rozlany z dużych komórek B, po dwóch lub większej liczbie linii leczenia systemowego u osób dorosłych | ONKO | TAK | Decyzja wydana |
8 | Yescarta | aksykabtagen cyloleucel | Pierwotny chłoniak śródpiersia z dużych komórek B, po dwóch lub większej liczbie linii leczenia systemowego u osób dorosłych | ONKO | TAK | Decyzja wydana |
9 | Veltassa | patiromer | Hiperkaliemia u osób dorosłych | NIEONKO | NIE | Brak wniosku |
10 | Zubsolv | buprenorfina + nalokson | Leczenie substytucyjne uzależnienia od narkotyków opioidowych w ramach leczenia medycznego, społecznego i psychologicznego. Przeznaczone dla osób dorosłych i młodzieży w wieku powyżej 15 lat wyrażających zgodę na leczenie uzależnienia | NIEONKO | NIE | Brak wniosku |
11 | Braftovi | enkorafenib | Przerzutowy rak jelita grubego z obecnością mutacji BRAF V600E, u osób dorosłych, u których wcześniej stosowano leczenie systemowe, w skojarzeniu z cetuksymabem | ONKO | NIE | Brak wniosku |
12 | Kaftrio | iwakaftor + tezakaftor + eleksakaftor | Mukowiscydoza u osób w wieku co najmniej 12 lat, z homozygotyczną mutacją F508del genu mukowiscydozowego przezbłonowego regulatora przewodnictwa lub heterozygotyczną mutacją F508del genu CFTR z minimalną wartością funkcji w schemacie leczenia skojarzonego z iwakaftorem w dawce 150 mg w postaci tabletek | NIEONKO | TAK | Decyzja wydana |
13 | Symkevi | tezakaftor + iwakaftor | Mukowiscydoza u osób w wieku co najmniej 6 lat, z homozygotyczną mutacją F508del w skojarzeniu z iwakaftorem w dawce 150 mg w postaci tabletek | NIEONKO | TAK | Decyzja wydana |
14 | Symkevi | tezakaftor + iwakaftor | Mukowiscydoza u osób w wieku co najmniej 6 lat, z heterozygotyczną mutacją F508del i jedną z następujących mutacji genu mukowiscydozowego przezbłonowego regulatora przewodnictwa : P67L, R117C, L206W, R352Q, A455E, D579G, 711+3A→G, S945L, S977F, R1070W, D1152H, 2789+5G→A, 3272-26A→G i 3849+10kbC→T w skojarzeniu z iwakaftorem w dawce 150 mg w postaci tabletek | NIEONKO | TAK | Decyzja wydana |
Odnosząc się do technologii lekowych o wysokiej wartości klinicznej (TLK), dla których wykaz AOTMiT[8] był opracowany i opublikowany jednorazowo, warto podkreślić że 3 technologie lekowe dla pacjentów z mukowiscydozą zostały objęte refundacją od 1 marca 2022 r. (Kaftrio oraz Symkevi w obu wskazaniach), a kolejne 3 technologie lekowe dla pacjentów zmagających się z chłoniakiem rozlanym z dużych komórek B objęto refundacją od 1 maja 2022 r. (kolejne terapie CAR-T: Kymriah oraz Yescarta w obu wskazaniach). Dla jednej technologii lekowej, tj. Jorveza (budezonid) w leczeniu eozynofilowego zapalenia przełyku u osób dorosłych, postępowanie jest w toku. Dodatkowo należy wskazać, że dla siedmiu pozostałych technologii lekowych w ramach TLK wnioski o objęcie refundacją i ustalenie urzędowej ceny zbytu leku przez podmioty odpowiedzialne nie zostały jeszcze złożone.
Na technologie lekowe o wysokiej wartości klinicznej (TLK) z listy MZ[9] środki finansowe były dotychczas wydatkowane z ogólnego budżetu na refundację (nie z Funduszu Medycznego). Nie został złożony żaden wniosek o objęcie refundacją i ustalenie urzędowej ceny zbytu technologii lekowej o wysokiej wartości klinicznej (TLK) na podstawie art. 24 ust. 1a ustawy o refundacji, tylko zostały złożone wnioski o objęcie refundacją i ustalenie urzędowej ceny zbytu leku na podstawie art. 24 ust. 1 pkt 1 ustawy o refundacji (w ramach standardowej ścieżki refundacyjnej).
Przepisy ustawy z 1 grudnia 2022 r. o zmianie ustawy o Funduszu Medycznym oraz niektórych innych ustaw (Dz.U. z 2022 r. poz. 2674), wprowadziły w art. 33 ustawy z 7 października 2020 r. o Funduszu Medycznym ust. 4. W myśl tego przepisu w przypadku gdy w trakcie prowadzonego postępowania o objęcie refundacją i ustalenie urzędowej ceny zbytu leku lub wydania decyzji, na podstawie wniosku, o którym mowa w art. 24 ust. 1 pkt 1 ustawy z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych, lek został umieszczony na opublikowanej przez ministra właściwego do spraw zdrowia liście TLK w danym wskazaniu na podstawie wykazu publikowanego przez Agencję Oceny Technologii Medycznych i Taryfikacji, zgodnie z art. 40a ust. 3 ustawy z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych, lek ten jest finansowany w ramach środków, o których mowa w ust. 1.
W ramach TLK finansowaniem są obejmowane leki, które są w trakcie procesu administracyjnego oraz te, dla których wydano już decyzję o objęciu refundacją w dniu wejścia w życie tych przepisów.
[1] Przepisy ustawy z 1 grudnia 2022 r. o zmianie ustawy o Funduszu Medycznym z 7 października 2020 r. oraz niektórych innych ustaw (Dz.U. z 2022 r. poz. 2674)
[2] https://www.gov.pl/web/zdrowie/fmltowpi
[3] Warto dodać, iż podmiot odpowiedzialny po raz pierwszy złożył wnioski o objęcie refundacją i ustalenie urzędowej ceny zbytu leku Zolgensma 21 czerwca 2021 r. po przejściu wszystkich etapów procesu refundacyjnego opisanych w ustawie o refundacji Minister Zdrowia w dniu 8 listopada 2021 r. wydał negatywną decyzję w przedmiotowej sprawie. Następnie Wnioskodawca 17 listopada 2021 r. złożył wniosek o ponowne rozpatrzenie sprawy. Po przeprowadzeniu postępowania o ponowne rozpatrzenie sprawy, Minister Zdrowia w dniu 15 lutego 2022 r. postanowił utrzymać w mocy decyzję o odmowie objęcia refundacją i ustalenia urzędowej ceny zbytu leku. Firma złożyła ponownie wnioski o objęcie refundacją leku Zolgensma w tożsamym wskazaniu 17 maja 2022 r.
[4] Badania przesiewowe w kierunku SMA są składową Rządowego programu badań przesiewowych noworodków w Rzeczpospolitej Polskiej skierowanego do wszystkich dzieci urodzonych w RP. Od kwietnia 2021 został uruchomiony pilotaż badań przesiewowych w kierunku SMA, natomiast od 28 marca 2022 r. cała populacja została objęta badaniami.
Według najnowszych danych, w okresie 2021 - 07.2022 zdiagnozowano 38 noworodków z SMA na 281 817 zbadanych noworodków. W tym, w roku 2022 (do 07.2022) zdiagnozowano 23 noworodków z SMA na 168 034 zbadanych.
[5] Liczba dorosłych pacjentów o unikatowym numerze pesel. Grupę pacjentów charakteryzuje różny czas rozpoczęcia leczenia oraz różna ilość podanej substancji czynnej.
[6] https://bipold.aotm.gov.pl/index.php/tli/7669-wykaz-tli-2022
[7] https://www.gov.pl/web/zdrowie/lista-technologii-o-wysokim-poziomie-innowacyjnosci-z-30052022
[8] https://bipold.aotm.gov.pl/index.php/wykaz-tlk
[9] https://www.gov.pl/web/zdrowie/lista-technologii-lekowych-o-wysokiej-wartosci-klinicznej
Redaktor naczelna, od ponad 20 lat pracuje w mediach. Była redaktor naczelna Polityki Zdrowotnej, redaktor m.in. w Rzeczpospolitej, Dzienniku Gazecie Prawnej. Laureatka branżowych nagród dla dziennikarzy i mediów medycznych oraz Polskiej Izby Ubezpieczeń. Kontakt: aleksandra.kurowska@cowzdrowiu.pl