Autor : Aleksandra Kurowska
2022-05-18 12:09

Które leki powinny być sfinansowane w pierwszej kolejności z Funduszu medycznego?
Najpierw listę technologii przygotowali analitycy Agencji Oceny Technologii Lekowych i Taryfikacji. Opublikowano ją w lutym. Podstawą do oceny było zestawienie Europejskiej Agencji Leków (European, Medicines Agency, EMA) o zarejestrowanych w EMA i dopuszczonych do obrotu na terenie Unii Europejskiej (UE) produktach leczniczych w okresie 27.11.2020-26.11.2021 wg. stanu na dzień 31.12.2021 r.
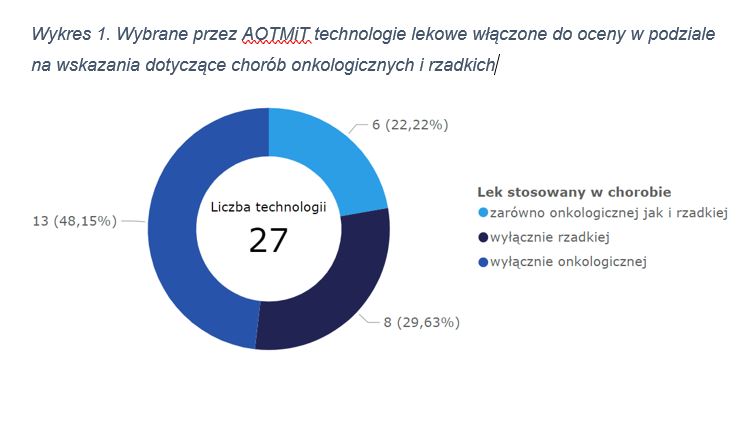
W tym czasie zostało zarejestrowanych przez EMA łącznie 89 leków stosowanych u ludzi, z czego aktualnie dopuszczonych do obrotu pozostaje 87 (2 utraciły ważność pozwolenia na dopuszczenie do obrotu). Uwzględniając precyzyjnie wskazania dla poszczególnych produktów leczniczych, szczegółową oceną objęto 27 technologii lekowych, z których AOTMiT wybrała 21.
Lista ta trafiła pod ocenę Rady Przejrzystości AOTMiT oraz Rzecznika Praw Pacjenta.
Rada Przejrzystości 16 maja w czasie posiedzenia zarekomendowała, by w pierwszej kolejności sfinansować 7 technologii lekowych.
Wybierając je kierowała się kryteriami:
• Istotność schorzenia (lub wskazania szczegółowego), na które składają się: ciężkość skutków i występowanie w Polsce.
• Zaspokojenie potrzeby zdrowotnej - dostępność w Polsce i skuteczność dostępnych technologii lekowych w tym schorzeniu.
• Siła wnioskowanej interwencji, uwzględniając jej skuteczność i bezpieczeństwo.
• Istotność najważniejszego punktu końcowego.
• Jakość dostępnych dowodów naukowych.
7 terapii z najwyższą oceną
W pierwszej kolejności sfinansowane powinny zostać (kategoria A):
Bylvay (odewiksybat) we wskazaniu: postępująca rodzinna cholestaza wewnątrzwątrobowa (ang. progressive familial intrahepatic cholestasis, PFIC) u pacjentów w wieku od 6 miesięcy.
Enspryng (satralizumab) we wskazaniu: choroby ze spektrum zapalenia nerwów wzrokowych oraz rdzenia kręgowego (zespół Devic'a), monoterapia lub w skojarzenie z terapią immunosupresyjną u pacjentów dorosłych i młodzieży w wieku powyżej 12 lat, u których występują przeciwciała IgG przeciwko akwaporynie-4 (AQP4-IgG).
Koselugo (selumetynib) we wskazaniu: leczenie objawowych, nieoperacyjnych nerwiakowłókniaków splotowatych (ang. plexiform neurofibromas, PN) u dzieci i młodzieży w wieku 3 lat i starszych z neurofibromatozą typu 1 (NF1).
Minjuvi (tafasytamab) we wskazaniu: nawrotowa albo oporna na leczenie postać chłoniaka nieziarniczego rozlanego z dużych komórek B (diffuse large B-cell lymphoma, DLBCL), w skojarzeniu z lenalidomidem, a następnie w monoterapii w leczeniu pacjentów dorosłych, którzy nie kwalifikują się do autologicznego przeszczepu komórek macierzystych (autologous stem cell transplant, ASCT).
Retsevmo (selperkatynib) we wskazaniu: zaawansowany rak rdzeniasty tarczycy (RRT) z mutacją w genie RET, w monoterapii, u dorosłych i młodzieży w wieku co najmniej 12 lat, którzy wymagają terapii systemowej po wcześniejszym leczeniu kabozantynibem i (lub) wandetanibem.
Voxzogo (wosorytyd) we wskazaniu: achondroplazja u pacjentów w wieku co najmniej 2 lat, których nasady kości długiej nie są zamknięte.
Trodelvy (sacytuzumab gowitekan) we wskazaniu: nieresekcyjny lub przerzutowy potrójnie ujemny rak piersi (ang. metastatic triple-negative breast cancer, mTNBC), w monoterapii, u dorosłych pacjentów, którzy wcześniej otrzymali co najmniej dwie linie leczenia systemowego, w tym co najmniej jedną w zaawansowanej chorobie.
3 leki do sfinansowania w drugiej kolejności
W drugiej kolejności (kategoria A/B):
Libmeldy (atidarsagen autotemcel) we wskazaniu: leukodystrofia metachromatyczna (ang. metachromatic leukodystrophy, MLD) odznaczająca się dwuallelowymi mutacjami genu arylosulfatazy A prowadzącymi do zmniejszenia aktywności enzymatycznej ARSA, w przypadku: - dzieci z późnymi niemowlęcymi albo wczesnymi młodzieńczymi postaciami choroby, bez objawów klinicznych choroby; - dzieci z wczesną młodzieńczą postacią choroby, z wczesnymi objawami klinicznymi choroby, mogące nadal poruszać się samodzielnie, przed pojawieniem się zaburzenia funkcji poznawczych.
Fintepla (fenfluramina (fenfluraminy chlorowodorek)) we wskazaniu: napady padaczkowe związane z zespołem Dravet, jako dodatek do leczenia innymi lekami przeciwpadaczkowymi u pacjentów w wieku od 2 lat.
Tecartus (autologiczne transdukowane anty-CD19 komórki CD3-dodatnie) we wskazaniu: nawrotowy lub oporny na leczenie chłoniak z komórek płaszcza (ang. mantle cell lymphoma, MCL) u dorosłych pacjentów, którzy uprzednio otrzymali co najmniej dwie linie leczenia systemowego, w tym inhibitor kinazy tyrozynowej Brutona (ang. Bruton’s tyrosine kinase, BTK).
11 terapii na "liście rezerwowej" - czyli do sfinansowania w dalszej kolejności
W trzeciej kolejności (kategoria B):
Abecma (idekabtagen wikleucel) we wskazaniu: nawrotowy i oporny na leczenie szpiczak mnogi, w leczeniu dorosłych pacjentów, u których stosowano wcześniej co najmniej trzy metody leczenia, w tym lek immunomodulujący, inhibitor proteasomu i przeciwciało antyCD38, i wykazano progresję choroby podczas ostatnio stosowanego leczenia.
Brukinsa (zanubrutynib) we wskazaniu: makroglobulinemia Waldenströma, u dorosłych pacjentów, którzy wcześniej stosowali co najmniej jedną metodę leczenia, albo w leczeniu pierwszego rzutu u pacjentów, którzy nie kwalifikują się do stosowania chemioimmunoterapii.
Enhertu (trastuzumab derukstekan) we wskazaniu: HER2-dodatni raki piersi, nieoperacyjny lub przerzutowy, monoterapia dorosłych pacjentów, którzy otrzymali dwa lub więcej schematów leczenia opartych na anty-HER2.
Gavreto (pralsetynib) we wskazaniu: RET-dodatni (ang. Rearranged During Transfection, RET) zaawansowany niedrobnokomórkowy rak płuca (NDRP), w monoterapii u pacjentów dorosłych nieleczonych wcześniej inhibitorem RET.
Imcivree (setmelanotyd) we wskazaniu: otyłość i kontrola uczucia głodu towarzyszącego potwierdzonemu w badaniach genetycznych związanemu z bialleliczną utratą funkcji niedoborowi proopiomelanokortyny (POMC), w tym PCSK1, lub receptora leptyny (LEPR) u osób dorosłych i dzieci w wieku od 6 lat.
Jemperli (dostarlimab) we wskazaniu: nawrotowy lub zaawansowany rak endometrium z upośledzeniem naprawy nieprawidłowo sparowanych nukleotydów (ang. mismatch repair deficient, dMMR)/wysoką niestabilnością mikrosatelitarną (ang. microsatellite instability-high, MSI-H), który uległ progresji w trakcie lub po zakończeniu wcześniejszego schematu leczenia zawierającego platynę, w monoterapii w leczeniu dorosłych pacjentek.
Nexpovio (selineksor) we wskazaniu: szpiczak mnogi, w skojarzeniu z deksametazonem u dorosłych, u których wcześniej zastosowano co najmniej cztery metody leczenia i u których choroba okazała się oporna na leczenie co najmniej dwoma inhibitorami proteasomu, dwoma środkami immunomodulującymi oraz przeciwciałem monoklonalnym przeciwko CD38 i którzy wykazywali progresję choroby na ostatniej terapii.
Pemazyre (pemigatynib) we wskazaniu: miejscowo zaawansowany albo przerzutowy rak dróg żółciowych z fuzją albo rearanżacją receptora czynnika wzrostu fibroblastów 2 (fibroblast growth factor receptor 2, FGFR2), w monoterapii, w leczeniu osób dorosłych z u których wystąpiła progresja choroby po przynajmniej jednej wcześniejszej linii leczenia ogólnoustrojowego.
Retsevmo (selperkatynib) we wskazaniu: zaawansowany rak tarczycy z obecnością fuzji genu RET, u dorosłych, którzy wymagają terapii systemowej po wcześniejszym leczeniu sorafenibem i (lub) lenwatynibem.
Retsevmo (selperkatynib) we wskazaniu: zaawansowany, niedrobnokomórkowy rak płuca (NDRP) z obecnością fuzji genu RET, w monoterapii, u dorosłych, którzy wymagają terapii systemowej po wcześniejszej immunoterapii i (lub) chemioterapii opartej na związkach platyny.
Tukysa (tukatynib) we wskazaniu: HER2-dodatni miejscowo zaawansowany rak piersi lub HER2-dodatni rak piersi z przerzutami, w skojarzeniu z trastuzumabem i kapecytabiną u dorosłych pacjentów, którzy otrzymali co najmniej 2 schematy leczenia skierowanego przeciwko receptorowi HER2 w przeszłości.
Przypomnijmy również, że tydzień temu Rzecznik Praw Pacjenta konsultował z organizacjami pozarządowymi zrzeszonymi w Radzie Organizacji Pacjentów listę technologii lekowych, którą przekazała Rada Przejrzystości AOTMiT. Zdaniem Rzecnika Praw Pacjenta na wykazie powinno znaleźć się 14 leków:
Bylvay (odewiksybat) we wskazaniu: postępująca rodzinna cholestaza wewnątrzwątrobowa (ang. progressive familial intrahepatic cholestasis, PFIC) u pacjentów w wieku od 6 miesięcy;
Enhertu (trastuzumab derukstekan) we wskazaniu: HER2-dodatni rak piersi, nieoperacyjny lub przerzutowy, monoterapia dorosłych pacjentów, którzy otrzymali dwa lub więcej schematów leczenia opartych na anty-HER2;
Enspryng (satralizumab) we wskazaniu: choroby ze spektrum zapalenia nerwów wzrokowych oraz rdzenia kręgowego (zespół Devic'a), monoterapia lub w skojarzenie z terapią immunosupresyjną u pacjentów dorosłych i młodzieży w wieku powyżej 12 lat, u których występują przeciwciała IgG przeciwko akwaporynie-4 (AQP4-IgG);
Fintepla (fenfluramina / fenfluraminy chlorowodorek) we wskazaniu: napady padaczkowe związane z zespołem Dravet, jako dodatek do leczenia innymi lekami przeciwpadaczkowymi u pacjentów w wieku od 2 lat;
Gavreto (pralsetynib) we wskazaniu: RET-dodatni (ang. Rearranged During Transfection, RET) zaawansowany niedrobnokomórkowy rak płuca (NDRP);
Koselugo (selumetynib) we wskazaniu: leczenie objawowych, nieoperacyjnych nerwiakowłókniaków splotowatych (ang. plexiform neurofibromas, PN) u dzieci i młodzieży w wieku 3 lat i starszych z neurofibromatozą typu 1 (NF1);
Libmeldy (atidarsagen autotemcel) we wskazaniu: leukodystrofia metachromatyczna (ang. metachromatic leukodystrophy, MLD) odznaczająca się dwuallelowymi mutacjami genu arylosulfatazy A, prowadzącymi do zmniejszenia aktywności enzymatycznej ARSA, w przypadku: - dzieci z późnymi niemowlęcymi albo wczesnymi młodzieńczymi postaciami choroby, bez objawów klinicznych choroby; - dzieci z wczesną młodzieńczą postacią choroby, z wczesnymi objawami klinicznymi choroby, mogące nadal poruszać się samodzielnie, przed pojawieniem się zaburzenia funkcji poznawczych;
Minjuvi (tafasytamab) we wskazaniu: nawrotowa albo oporna na leczenie postać chłoniaka nieziarniczego rozlanego z dużych komórek B (diffuse large B-cell lymphoma, DLBCL), w skojarzeniu z lenalidomidem, a następnie w monoterapii w leczeniu pacjentów dorosłych, którzy nie kwalifikują się do autologicznego przeszczepu komórek macierzystych (autologous stem cell transplant, ASCT);
Pemazyre (pemigatynib) we wskazaniu: miejscowo zaawansowany albo przerzutowy rak dróg żółciowych z fuzją albo rearanżacją receptora czynnika wzrostu fibroblastów 2 (fibroblast growth factor receptor 2, FGFR2), w monoterapii, w leczeniu osób dorosłych z u których wystąpiła progresja choroby po przynajmniej jednej wcześniejszej linii leczenia ogólnoustrojowego;
Retsevmo (selperkatynib) we wskazaniu: zaawansowany rak rdzeniasty tarczycy (RRT) z mutacją w genie RET, w monoterapii, u dorosłych i młodzieży w wieku co najmniej 12 lat, którzy wymagają terapii systemowej po wcześniejszym leczeniu kabozantynibem i (lub) wandetanibem;
Tecartus (autologiczne transdukowane anty-CD19 komórki CD3-dodatnie) we wskazaniu: nawrotowy lub oporny na leczenie chłoniak z komórek płaszcza (ang. mantle cell lymphoma, MCL) u dorosłych pacjentów, którzy uprzednio otrzymali co najmniej dwie linie leczenia systemowego, w tym inhibitor kinazy tyrozynowej Brutona (ang. Bruton’s tyrosine kinase, BTK);
Trodelvy (sacytuzumab gowitekan) we wskazaniu: nieresekcyjny lub przerzutowy potrójnie ujemny rak piersi (ang. metastatic triple-negative breast cancer, mTNBC), w monoterapii, u dorosłych pacjentów, którzy wcześniej otrzymali co najmniej dwie linie leczenia systemowego, w tym co najmniej jedną w zaawansowanej chorobie;
Tukysa (tukatynib) we wskazaniu: HER2-dodatni miejscowo zaawansowany rak piersi lub HER2-dodatni rak piersi z przerzutami, w skojarzeniu z trastuzumabem i kapecytabiną u dorosłych pacjentów, którzy otrzymali co najmniej 2 schematy leczenia skierowanego przeciwko receptorowi HER2 w przeszłości;
Voxzogo (wosorytyd) we wskazaniu: achondroplazja u pacjentów w wieku co najmniej 2 lat, których nasady kości długiej nie są zamknięte.
Zobacz także:
 Fundusz Medyczny: które leki do finansowania wskazał RPP?
Fundusz Medyczny: które leki do finansowania wskazał RPP?
 Już jest! Nowy wykaz technologii lekowych wysoce innowacyjnych AOTMiT
Już jest! Nowy wykaz technologii lekowych wysoce innowacyjnych AOTMiT
Redaktor naczelna, od ponad 20 lat pracuje w mediach. Była redaktor naczelna Polityki Zdrowotnej, redaktor m.in. w Rzeczpospolitej, Dzienniku Gazecie Prawnej. Laureatka branżowych nagród dla dziennikarzy i mediów medycznych oraz Polskiej Izby Ubezpieczeń. Kontakt: aleksandra.kurowska@cowzdrowiu.pl